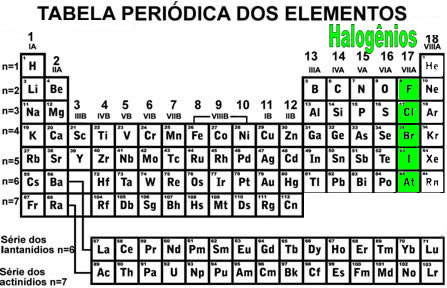
Segundo a Agência Nacional de Vigilância Sanitária (ANVISA), rótulo é toda inscrição, legenda e imagem ou, toda matéria descritiva ou gráfica que esteja escrita, impressa, estampada, gravada ou colada sobre a embalagem do alimento.
Os alimentos industrializados são identificados pelo rótulo presente em sua embalagem. O rótulo é responsável por trazer dados importantes do produto ao consumidor como
Lista de ingredientes que compõem o produto. Essa lista deve estar em ordem decrescente, ou seja, primeiro devem aparecer os itens presentes em maior quantidade.
Origem do produto, ou seja, o nome de sua empresa e endereço de fabricação. É importante colocar também informações de contato de atendimento ao consumidor.
Lote e Prazo de validade. Para produtos com prazo inferior a três meses, é necessário o dia, mês e ano. Para os demais, apenas o mês e ano.
Conteúdo líquido, expresso em massa (gramas / quilos), ou em volume (ml, litros). Em alguns casos (como conservas), é necessário informar também a massa do conteúdo drenado.
Informação Nutricional Obrigatória, também chamada tabela nutricional. Veja abaixo mais detalhes de sua apresentação e composição.
Atributos nutricionais complementares: Informações geralmente destinadas a portadores de determinadas doenças, como “Contém glúten” ou “Não contém glúten”, alimentos de teor reduzido de açúcares, gordura ou determinado nutriente (alimentos diet e light), ou produtos que podem conter traços de amendoim, amêndoas, soja e leite.
Os rótulos presentes nos produtos industrializados são confiáveis? Essa é uma questão que foi abordada por estudantes da Universidade de Brasília. O estudo revelou que 12% das embalagens dos alimentos brasileiros apresentam irregularidades nos rótulos, elas funcionam como uma armadilha para o consumidor.
Os alimentos industrializados são identificados pelo rótulo presente em sua embalagem. O rótulo é responsável por trazer dados importantes do produto ao consumidor como
Lista de ingredientes que compõem o produto. Essa lista deve estar em ordem decrescente, ou seja, primeiro devem aparecer os itens presentes em maior quantidade.
Origem do produto, ou seja, o nome de sua empresa e endereço de fabricação. É importante colocar também informações de contato de atendimento ao consumidor.
Lote e Prazo de validade. Para produtos com prazo inferior a três meses, é necessário o dia, mês e ano. Para os demais, apenas o mês e ano.
Conteúdo líquido, expresso em massa (gramas / quilos), ou em volume (ml, litros). Em alguns casos (como conservas), é necessário informar também a massa do conteúdo drenado.
Informação Nutricional Obrigatória, também chamada tabela nutricional. Veja abaixo mais detalhes de sua apresentação e composição.
Atributos nutricionais complementares: Informações geralmente destinadas a portadores de determinadas doenças, como “Contém glúten” ou “Não contém glúten”, alimentos de teor reduzido de açúcares, gordura ou determinado nutriente (alimentos diet e light), ou produtos que podem conter traços de amendoim, amêndoas, soja e leite.
Os rótulos presentes nos produtos industrializados são confiáveis? Essa é uma questão que foi abordada por estudantes da Universidade de Brasília. O estudo revelou que 12% das embalagens dos alimentos brasileiros apresentam irregularidades nos rótulos, elas funcionam como uma armadilha para o consumidor.

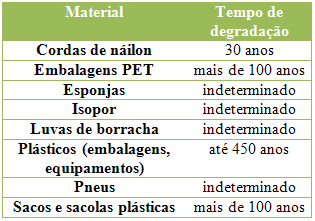





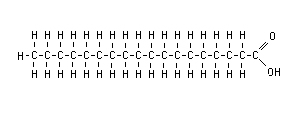
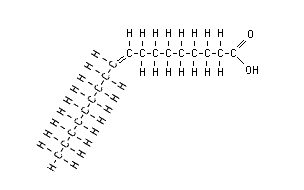


![Resultado de imagem para datação pelo carbono 14]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiS3LF-hF8R3pRYvKgp81lUrgaNGkOUmqTqY2vmg5rqat7FxekIgSWppBveBgvaiyc12OQuLy4NZIKllGXx4rxsvqMz41M8U4Ru_9yItUqqZXRn0uJ66qGovy-lGq-xXx3yeK65lgb-CBU/s1600/determinando+a+idade+dos+fosseis.jpg)


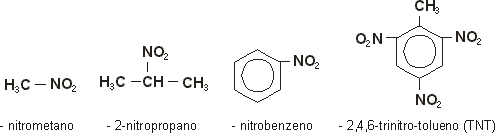








.jpg?i=http://brasilescola.uol.com.br/upload/e/butano(2).jpg&w=600&h=350&c=FFFFFF&t=1)

.jpg)

.jpg)