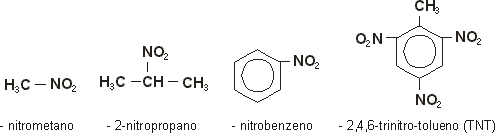
Nomenclatura oficial IUPAC: nitro + nome do hidrocarboneto
Alguns exemplos importantes:
2- Propriedades físicas
Os nitrocompostos são isômeros dos nitritos. A diferença é que nos primeiros, o nitrogênio está ligado diretamente à cadeia carbônica (R - NO2), enquanto que, no nitritos, a ligação do nitrogênio à cadeia carbônica é feita através de um átomo de oxigênio (R - O - N=O). Os nitroalcanos são líquidos incolores, densos, de cheiro agradável, não venenosos e insolúveis em água. São substâncias muito polares de modo que seus pontos de fusão e ebulição e densidade são bem superiores aos dos nitritos isômeros. veja um exemplo:
| H3C-NO2 | PE = 102o C |
| H3C-O-N=O | PE = -12o C |
O nitrobenzeno é um líquido amarelado, insolúvel e mais denso que a água, venenoso e bom solvente para substâncias orgânicas. Os nitrotoluenos também são líquidos. Já os dinitro e trinitro-benzenos (e toluenos) são sólidos explosivos. Veja a síntese do 2,4-dinitrotolueno.
3- Métodos de obtenção
Os nitrocompostos geralmente são preparados pela reação com ácido nítrico. Essa reação é chamada nitração:
Para alifáticos: Nitração de alcanos
Para aromáticos: Nitração do benzeno (ou derivados)
As reações de obtenção dos nitrocompostos alifáticos são mais difíceis e dão rendimentos bem mais baixos que os apresentados pelos nitrocompostos aromáticos. Exige-se uma temperatura de cerca de 400o C, em fase de vapor, de uma mistura de alcano e ácido nítrico. A nitração de um alcano torna-se mais fácil ao passar-se do carbono primário para secundário e para terciário (veja mais detalhes na teoria da estabilidade dos carbocátions).
4- Propriedades químicas
O grupo NO2 gera um forte efeito desativador do anel aromático, facilitando as substituições eletrofílicas preferencialmente na posição meta (1,3). Veja abaixo as possíveis estruturas de ressonância para o nitro-benzeno:

Veja que as posições orto e para possuem baixa densidade eletrônica, pois ficam constantemente destituídos de elétrons. Logo, o composto sofrerá facilmente ataques eletrófilos na posição meta. Ora, se o primeiro radical (NO2) diminui a densidade eletrônica do anel, ele é um grupo desativador, e diminui a reatividade do composto.
Os nitroalcanos têm um pequeno caráter ácido, proveniente do equilíbrio abaixo:
equilíbrio nitro-froma/aci-forma nos nitroalcanos
Este equilíbrio é semelhante ao equilíbrio que ocorre nos aldeídos (equilíbrio aldo-enólico), nas cetonas (equilíbrio ceto-enólico) e nos ésteres. No entanto, a acidez da aci-froma é mais pronunciada do que a dos enóis. Em alguns casos podemos até separar as duas formas, como por exemplo: Ph-CH2-NO2 (líquido oleoso amarelo) e Ph-CH=NOOH (sólido branco). Através da aci-forma, os alcanos reagem com bases fortes, produzindo os sais correspondentes:
R-CH=NO2H (aci-forma) + NaOH R-CH=NO2Na (sal) + H2O
5- Aplicações dos nitrocompostos
- Os nitroalcanos são usados como solventes e como intermediários na produção de outros compostos orgânicos;
- Por seu odor agradável (lembra amêndoas amargas) o nitrobenzeno é utilizado na fabricação de perfumes baratos;
- O trinitro-tolueno, mais conhecido como TNT, é um dos explosivos mais utilizados no mundo;
- Os mono-nitrocompostos aromáticos (nitrobenzenos, nitrotoluenos, nitroxilenos) são importantes para a obtenção de aminas aromáticas, usadas na produção de corantes orgânicos;
- O 2,4,6-trinitrofenol (ácido pícrico) além de ser utilizado na fabricação de explosivos (como o picrato de sódio), é usado como germicida e na fabricação de medicamentos (como o picrato de butesina, usado em queimaduras);

Nenhum comentário:
Postar um comentário